新华制药全资子公司盐酸西替利嗪片(10mg)首家通过仿制药一致性评价
鲁网8月19日讯(见习记者 黄钰淇)山东新华制药股份有限公司(新华制药.000756.sz)于8月18日晚间发布公告。公告显示,新华制药全资子公司新华制药高密有限公司(下文简称“新华制药高密公司”)于近日收到国家药品监督管理局核准签发的盐酸西替利嗪片10mg规格的《药品补充申请批件》,该产品通过仿制药质量和疗效一致性评价。新华制药高密公司成为国内首家通过盐酸西替利嗪片(10mg)仿制药一致性评价的企业。

记者从报告获悉,2018年07月16日,新华制药高密公司向国家药品监督管理局递交的本产品仿制药一致性评价注册申报资料获受理。该产品用于季节性鼻炎、常年性过敏性鼻炎、过敏性结膜炎及过敏引起的瘙痒和荨麻疹的对症治疗。
盐酸西替利嗪片最早由 UCB Pharma SA 公司开发和推出,并与各许可证持有商联合销售,是一种安全、长效的高选择性非镇静组胺H1受体拮抗剂。目前,于中国境内已上市的盐酸西替利嗪片企业包括新华制药高密公司、扬子江药业、齐鲁制药等。
根据国家相关政策规定,对于通过仿制药一致性评价的药品品种,在医保支付方面予以适当支持,医疗机构应优先采购并在临床中优先选用。同品种药品通过仿制药一致性评价的生产企业达到 3 家以上的,在药品集中采购等方面不再选用未通过仿制药一致性评价的品种。
因此,新华制药高密公司的盐酸西替利嗪片通过仿制药一致性评价,有利于提升该产品的市场竞争力,同时为后续仿制药一致性评价产品的研发工作积累了宝贵的经验。
经查询相关资料,盐酸西替利嗪制剂2018年全球销售额约为8.84亿美元,该产品作为第二代H1受体拮抗剂在中国国内市场成为受临床欢迎的主要抗过敏药物。
截至2019年7月31日,新华制药用于盐酸西替利嗪片一致性评价项目研发费用投入约为人民币800万元。该产品为非处方药(OTC)。
山东新华制药股份有限公司始创于1943年,公司于1996年与1997年期间先后在香港联合交易所和深圳证券交易所挂牌上市,目前法定代表人为张代铭。
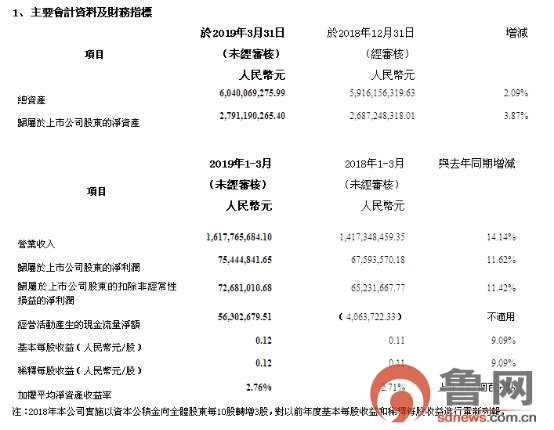
据新华制药官网披露的2019年第一度业绩报告显示,新华制药2019年第一季度营业收入达16.17亿元,较上年同期增长14.14%;归属于上市公司股东的净利润为0.75亿元,同比增长11.62%;扣除非经常性损益的净利润为0.72亿元,同比增长11.42%;基本每股收益0.12元,同比增长9.09%;归属于上市公司股东净资产达27.91亿元,同比增长3.87%;总资产达60.40亿元,同比增长2.09%。
(主要会计资料及财务指标)
- 国内第三家 新华制药卡托普利片(25mg) 通过仿制药一致性评价2019-11-21
- 新华制药成国内首家头孢拉定胶囊(0.25g)通过仿制药一致性评价企业2019-09-18